Điều trị miễn dịch bệnh ung thư đầu cổ giai đoạn muộn: tái phát và di căn tại Trung tâm Y học hạt nhân và ung bướu-Bệnh viện Bạch Mai
GS.TS. Mai Trọng Khoa, BSNT. Nguyễn Bình Dương, ThS.BS. Trần Văn Oai, PGS.TS.BS. Phạm Cẩm Phương
Trung tâm Y học hạt nhân và Ung bướu, Bệnh viện Bạch Mai
Ung thư biểu mô vảy đầu cổ là một trong những nguyên nhân chính gây ra gánh nặng tàn tật và tử vong do ung thư trên thế giới. Điều trị ung thư biểu mô vảy đầu cổ cũng không nằm ngoài nguyên tắc điều trị bệnh ung thư nói chung, đó là phụ thuộc vào giai đoạn bệnh khi mới chẩn đoán. Khoảng 40% các trường hợp ung thư đầu cổ được chẩn đoán ở giai đoạn sớm và được điều trị bằng phẫu thuật hoặc xạ trị triệt căn. 60% còn lại được chẩn đoán ở giai đoạn bệnh tiến triển tại chỗ, phương thức điều trị lúc này là phẫu thuật hoặc hóa xạ đồng thời sau đó là hóa chất bổ trợ. Khi bệnh tái phát/di căn không còn khả năng điều trị triệt căn, điều trị hóa chất với nền tảng nhóm platin là phương pháp điều trị cơ bản. Trung vị sống còn của các bệnh nhân ung thư đầu cổ ở giai đoạn tái phát/di căn được điều trị bằng hóa chất nhóm platin là 7.4 tháng, với trường hợp bệnh kháng với hóa chất thì thời gian sống còn chỉ là 4 tháng.
Bên cạnh các phương pháp điều trị ung thư truyền thống như phẫu thuật, xạ trị, hóa chất, nội tiết… thì trong những năm gần đây đã có thêm một số phương pháp điều trị mới, đó là điều trị đích (Tageted therapy) và điều trị miễn dịch (immunotherapy).
Một vài thông tin về điều trị miễn dịch trong ung thư
Cơ chế của điều trị miễn dịch trong ung thư liên quan đến chặt chẽ đến các trạm (điểm) kiểm soát (checkpoint) miễn dịch và ức chế các điểm kiểm soát này.
Hệ thống miễn dịch bình thường sẽ có các trạm (điểm) kiểm soát miễn dịch. Các điểm kiểm soát này có nhiệm vụ không để các vật lạ nào được xâm nhập vào cơ thể và đồng thời cho phép các tế bào của cơ thể của chúng ta hoạt động được bình thường, có nghĩa là không tấn công vào tế bào bình thường của cơ thể chúng ta (nhằm tránh xảy ra các bệnh tự miễn).
Các tế bào ung thư cũng được hệ miễn dịch xem như tác nhân lạ đối với cơ thể và hệ thống miễn dịch khi nhận diện được chúng và sau đó sẽ hoạt hóa chức năng tiêu diệt tế bào ung thư. Tuy nhiên bằng nhiều cách khác nhau, các tế bào ung thư có thể lẩn trốn qua được các điểm kiểm soát của hệ miễn dịch, tạo điều kiện cho chúng phát triển và lan tràn…
Điểm kiểm soát (Checkpoint) miễn dịch thực chất là các thụ thể bề mặt (receptor), có chức năng điều hòa các tín hiệu tế bào và kìm hãm hoạt động miễn dịch (đóng vai trò như một chiếc phanh) của lympho T.
Hiện nay có 2 loại checkpoint: CTLA-4 (cytotoxic T-lymphocyte-associated protein 4) và PD-1 (Programmed cell death protein 1) đều có trên bề mặt tế bào T.
Một vài thông tin về cơ chế của điều trị miễn dịch ung thư
Trong vi môi trường ung thư, các tế bào ung thư thường tăng cường biểu hiện mối liên kết giữa CTLA-4 với các phối tử của nó (CTLA-4 ligand/CTLA4), cũng như PD1/PDL1 ligand từ đó làm bất hoạt tế bào T miễn dịch tiếp cận tế bào ung thư. Do đó, ngăn cản hoạt động của các thụ thể checkpoint trong dó có CTLA-4 là một hướng nghiên cứu đầy tiềm năng trong điều trị ung thư.
Điểm kiểm soát miễn dịch CTLA-4 và các thuốc ức chế CTLA-4
Trong điều kiện bình thường thì CTLA-4 có thể được coi là một chiếc “phanh” sinh lý đối với quá trình kích hoạt tế bào T nhờ sự liên kết với tế bào trình diện kháng nguyên (APC), từ đó giúp cơ thể chúng ta hoạt động được bình thường và an toàn. Tức là khi CTLA-4 liên kết với một loại protein có ở trên bề mặt tế bào trình diện kháng nguyên (được gọi là B7), thì nó giúp ngăn tế bào T tiêu diệt các tế bào khác, bao gồm cả tế bào bình thường và cả tế bào ung thư.
Như vậy, nếu chúng ta tìm cách nào đó ngăn chặn CTLA-4 của tế bào T để chúng không thể liên kết được với protein B7 có trong tế bào trình diện kháng nguyên và không bị ức chế ngay cả khi tế bào T được kích hoạt thì chúng ta sẽ giải phóng được tế bào T khỏi sự ức chế nói trên.
Nếu chúng ta dùng 1 kháng thể đơn dòng (được ví như một chiếc chìa khóa) kháng lại CTLA-4 (đóng vai trò như một ổ khóa), thì làm cho CTLA4 này không còn cơ hội để gắn với protein B7. Từ đó giúp tế bào T không bị CTAL-4 ức chế, lúc này chiếc “phanh” được nhả ra và tế bào T được giải phóng và quay lại tiêu diệt tế bào ung thư.
Hiện nay, một số thuốc ức chế CTLA-4 đang được phát triển và ứng dụng để điều trị cho một số loại ung thư khác, như ipilimumab, tremerimumab …
Điểm kiểm soát miễn dịch PD-1/PD-L1 và các thuốc ức chế PD-1, PD-L1
PD-1 (Programmed cell death protein 1: protein mã hóa chết theo chương trình 1) là một loại protein nằm trên màng tế bào lympho T, được xác định là điểm kiểm soát miễn dịch quan trọng để điều chỉnh phản ứng của tế bào T và B đối với các kháng nguyên, tham gia vào sự ức chế miễn dịch.
PD-1 (có trên bề mặt tế bào T, được ví như ổ khóa) liên kết với 2 protein: PD-L1 và PD-L2 (được ví như chiếc chìa khóa, được biểu hiện rộng rãi trên nhiều loại tế bào ung thư).
Một khi PD-L1 (của tế bào ung thư) liên kết và gắn được với PD1 (có ở trên tế bào T) thì sẽ tạo thành phức hợp PD-1/PDL1: sẽ gây ức chế sự tăng trưởng và phân chia của tế bào T, làm cho tế bào T bị bất hoạt, mất khả năng tiêu diệt các tế bào ung thư, vì thế mà các tế bào ung thư có thể lẩn trốn khỏi hệ thống miễn dịch, gây ra tiến triển của bệnh ung thư và thất bại trong điều trị …
Nếu ta dùng một kháng thể đơn dòng (KTĐD) kháng lại PD1 của tế bào T hoặc kháng lại PD-L1 của tế bào ung thư thì sẽ ngăn cản được sự kết hợp giữa PD1 và PD-L1, từ đó sẽ giúp ngăn chặn con đường tín hiệu này gây ức chế và “tự chết” của lympho T, giúp tế bào T được hoạt hóa trở lại, tế bào T được giải phóng khỏi tế bào ung thư, nhận diện được tế bào ung thư, chức năng miễn dịch của tế bào lympho T được tăng cường, từ đó giúp tấn công và tiêu diệt tế bào ung thư.
Hiện nay một số kháng thể đơn dòng đã được ứng dụng trong lâm sàng để điều trị ung thư như:
Các kháng thể đơn dòng kháng lại PD1: Pembrolizumab, Nivolumab…
Các kháng thể đơn dòng kháng lại PD-L1: Atezolizumab, Durvalumab…
Ca lâm sàng:
Dưới đây chúng tôi xin giới thiệu một case lâm sàng về bệnh nhân ung thư hạ họng tái phát sau hóa xạ trị, được điều trị bằng liệu pháp miễn dịch với Pembrolizumab phối hợp với hóa chất tại Trung tâm Y học hạt nhân và Ung bướu – Bệnh viện Bạch Mai.
Bệnh nhân Nam, 62 tuổi.
Tiền sử: Nghiện rượu và hút thuốc lá nhiều năm.
Diễn biến bệnh:
Tháng 10/2022 bệnh nhân được chẩn đoán ung thư hạ họng di căn hạch cổ cT2N2M0, đã được điều trị hóa xạ trị đồng thời. Bệnh đáp ứng một phần, còn hạch cổ nhỏ, sau đó bệnh nhân được điều trị duy trì bằng Capecitabine.
Tháng 9/2023 bệnh nhân vào viện vì xuất hiện khối u vùng cổ to nhanh và đau.
Khám lúc vào viện: bệnh nhân tỉnh, thể trạng PS 1, có khối sùi loét lớn vùng cổ trái chảy máu, đau nhiều VAS 7đ, hạn chế quay cổ, ăn uống kém, các cơ quan khác chưa phát hiện bất thường.
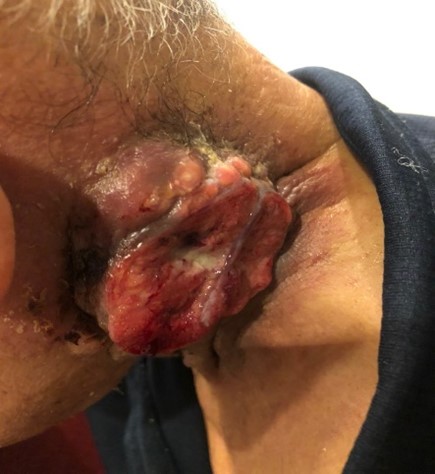
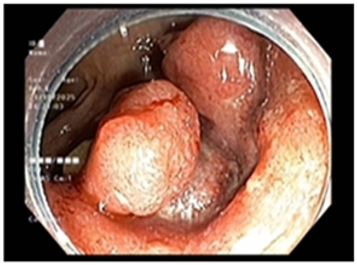
Hình 1. Khối u vùng cổ trái sưng to, sùi loét và chảy máu
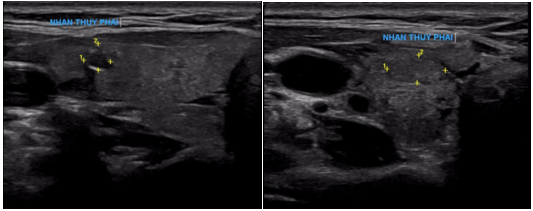
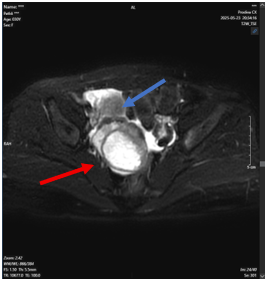
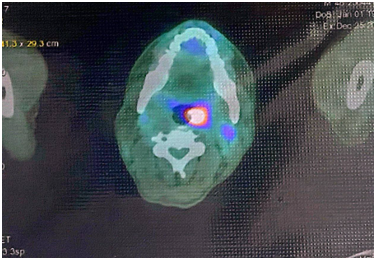
Bệnh nhân được chụp cắt lớp vi tính hàm mặt: Tại vị trí dưới hàm trái có khối tổ chức kích thước 71x60mm xâm lấn khoang cảnh, xâm lấn khoang cạnh hầu bên trái, không rõ ranh giới với tuyến mang tai trái, xâm lấn rộng da và tổ chức dưới da gây sùi loét rộng.
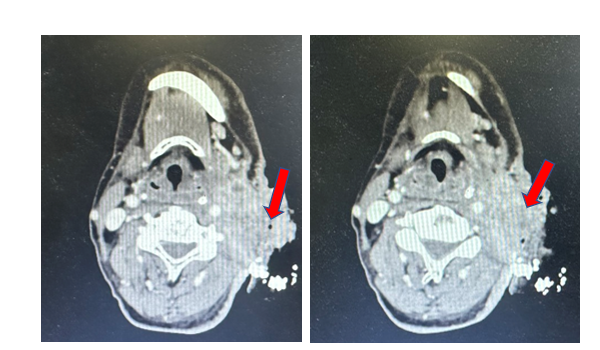 Hình 2. Khối dưới hàm trái xâm lấn rộng tương ứng tổn thương ác tính tái phát
Hình 2. Khối dưới hàm trái xâm lấn rộng tương ứng tổn thương ác tính tái phát
Bệnh nhân được sinh thiết khối u dưới hàm trái, kết quả mô bệnh học: ung thư biểu mô vảy.
Bệnh nhân được chẩn đoán xác định: ung thư hạ họng loại biểu mô vảy tái phát sau hóa xạ trị T4NxM0.
Bệnh nhân được lựa chọn điều trị phác đồ: CF + Pembrolizumab chu kì 21 ngày.
- Cisplatin 100 mg/m2 truyền tĩnh mạch ngày 1.
- 5-FU 1000 mg/m2 truyền tĩnh mạch ngày 1-4.
- Pembrolizumab 200 mg truyền tĩnh mạch ngày 1.
Bệnh nhân được đánh giá sau mỗi 3 chu kỳ.
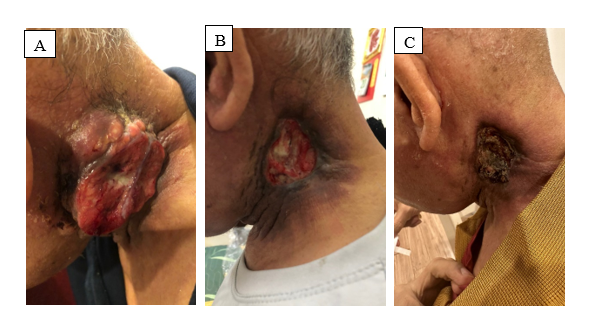
Hình 3. Đánh giá sau 1 chu kỳ CF + Pembrolizuma: A. Trước điều trị; B. Sau 10 ngày; C. Sau 3 tuần.
Sau 1 chu kỳ điều trị CF + Pembrolizumab, bệnh nhân giảm đau vùng cổ nhiều, có thể ăn uống và quay cổ một phần.
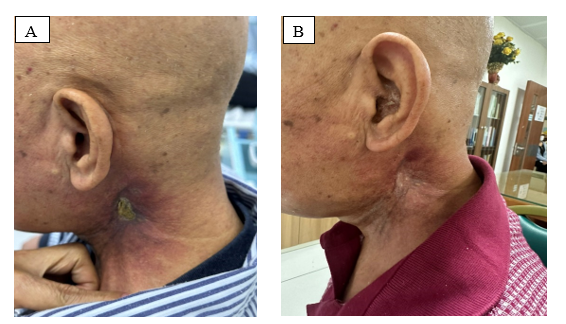
Hình 4. A. Sau 3 chu kì điều trị; B. Sau 6 chu kì điều trị
Sau 6 chu kỳ, bệnh nhân cải thiện nhiều trên lâm sàng: tăng 3 kg, có thể vận động vùng cổ và sinh hoạt bình thường, không còn triệu chứng đau, tổn thương sùi loét biến mất, chỉ còn sẹo trên da.
Trên hình ảnh cắt lớp vi tính: sau 6 chu kỳ điều trị, kích thước khối u giảm từ 71x60mm (trước điều trị) xuống 32x25mm, đánh giá bệnh đáp ứng một phần theo tiêu chuẩn RECIST 1.1

Hình 5. A. Trước điều trị; B. Sau 3 chu kì điều trị; C. Sau 6 chu kì điều trị
Sau 6 chu kì CF + Pembrolizumab, bệnh nhân được chuyển sang duy trì Pembrolizumab 200 mg truyền tĩnh mạch, chu kì 21 ngày.
Thay lời kết:
Các chất ức chế chốt kiểm soát miễn dịch (ICIs) đã trở thành liệu pháp mới nhiều hứa hẹn trong điều trị ung thư biểu mô vảy đầu cổ những năm gần đây. Các kháng thể đơn dòng thường được kết hợp với hóa chất do tác động hiệp đồng dưới nhiều cơ chế khác nhau. Hóa chất có thể tăng cường hiệu quả của các phân tử ức chế chốt kiểm soát miễn dịch do kích thích giải phóng các kháng nguyên, điều chỉnh vi môi trường khối u thông qua tác động ức chế các tế bào lympho T điều hòa (Tregs) và các tế bào ức chế nguồn gốc tủy xương (MDSCs), giảm biểu hiện PD-L2 trên bề mặt các tế bào u và tế bào tua. Ngoài ra, hóa chất kích hích sự trưởng thành của các tế bào trình diện kháng nguyên và làm tăng biểu hiện phân tử MHC-I. Sự hiểu biết về miễn dịch học trong ung thư ngày càng sâu rộng đã giúp thúc đẩy sự phát triển của liệu pháp miễn dịch trong điều trị ung thư biểu mô vảy đầu cổ. Nhiều nghiên cứu về hiệu quả của ICI trong điều trị bước một ung thư đầu cổ giai đoạn tái phát/di căn đã được tiến hành. Kết quả cho thấy Pembrolizumab kết hợp hóa chất nền tảng nhóm platin đã trở thành điều trị bước một tiêu chuẩn cho ung thư biểu mô vảy đầu cổ giai đoạn tái phát/di căn.
Bệnh này này đã được áp dụng phác đồ điều trị: Kháng thể đơn dòng Pembrolizumab kết hợp với hóa chất (phác đồ CF) đã cho thấy hiệu quả rõ rệt đối với các bệnh nhân ung thư đầu cổ, tái phát, di căn và đã ở giai đoạn muộn.