CASE LÂM SÀNG: BỆNH NHÂN UNG THƯ VÚ TÁI PHÁT ĐIỀU TRỊ BẰNG LIỆU PHÁP NỘI TIẾT KẾT HỢP THUỐC ỨC CHẾ CDK 4/6
GS.TS Mai Trọng Khoa, PGS.TS Phạm Cẩm Phương, BSNT. Phùng Thế Thông
Ung thư vú là một trong năm ung thư hay gặp nhất tại Việt Nam với tỉ lệ mắc mới tăng dần lên trong những năm gần đây. Việc điều trị ung thư vú ngày nay đã gặp được nhiều bước tiến lớn trong việc cải thiện thời gian sống thêm toàn bộ và thời gian sống bệnh không tiến triển nhờ nhiều phương thức điều trị mới, đặc biệt kể đến vai trò của các thuốc điều trị đích và liệu pháp miễn dịch. Tỉ lệ bệnh nhân ung thư vú dương tính với thụ thể nội tiết và âm tính với HER-2 (human epidermal growth factor – yếu tố tăng trưởng biểu mô 2) có thể lên đến 70% [1] và điều trị nội tiết là xương sống trong kiểu hình bệnh này. Việc bổ sung thêm các thuốc ức chế CDK4/6 (cyclin-dependent kinase 4 and 6, kinase phụ thuộc cyclin 4/6) kết hợp thuốc nội tiết giúp cải thiện khả năng sống sót, tăng hiệu quả ngăn chặn sự sinh sản của các tế bào khối u và làm chậm sự tiến triển của bệnh và là điều trị khuyến cáo đầu tay đối với bệnh nhân ung thư vú giai đoạn muộn có kiểu hình hóa mô miễn dịch nêu trên.
Dưới đây là một case lâm sàng minh họa điều trị ung thư vú tái phát bằng điều trị nội tiết kết hợp thuốc kháng CDK 4/6 tại Trung tâm Y học hạt nhân và Ung bướu, Bệnh viện Bạch Mai.
Bệnh nhân P. T. H, nữ, 70 tuổi.
Địa chỉ: Hà Đông, Hà Nội
Nghề nghiệp: tự do
Lý do vào viện: khối vùng cổ trái
Bệnh sử:
Năm 2014, bệnh nhân được chẩn đoán ung thư vú trái đã phẫu thuật cắt toàn bộ tuyến vú trái, nạo vét hạch; Giải phẫu bệnh sau mổ là: Ung thư biểu mô xâm nhập, ER (+); PR 10%, Her 2(-); Ki67 20%. Sau đó được điều trị bổ trợ hóa chất 4AC-4T; xạ trị gia tốc 50 Gy. Bệnh đạt ổn định. Bệnh nhân tái khám và theo dõi bệnh thường xuyên
Tháng 1/2022, bệnh nhân xuất hiện khối vùng cổ trái nghi ngờ tổn thương hạch => vào viện TT YHHN và Ung bướu xét chẩn đoán và điều trị
Khám tại thời điểm vào viện:
- Bệnh nhân tỉnh
- Thể trạng trung bình, chiều cao: 150cm cân nặng: 63kg
- Tim đều, không có tiếng thổi bệnh lý
- Phổi không rale
- Bụng mềm, không chướng.
- Hạch thượng đòn trái khoảng 1cm, mật độ chắc, di động kém
Cận lâm sàng
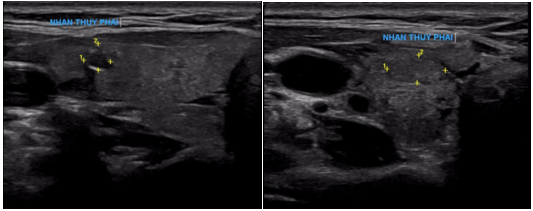
- Siêu âm hạch vùng cổ: hạch thượng đòn trái kích thước 1.19×0.9 cm, theo dõi dạng bệnh lý. Kết quả chọc kim nhỏ làm tế bào học (FNA) là: Ung thư biểu mô.
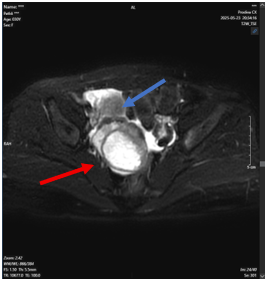
- Sinh thiết làm mô bệnh học và hóa mô miễn dịch: Ung thư biểu mô tuyến ống di căn hạch, ER (3+), PR (-), Her-2 (-), Ki67 (15%).
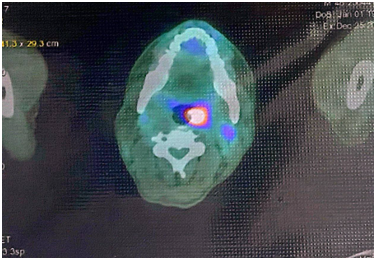
Kết quả chụp PET/CT (2/2022), cho thấy:
- Tuyến vú trái đã phẫu thuật, Không phát hiện hình ảnh tăng chuyển hóa FDG khu trú do tái phát tại chỗ hay di căn hạch hố nách trái
- Vài hạch thượng đòn trái, tăng chuyển hóa FDG do di căn: hạch lớn nhất 15x6mm (SUV: 3)
- Chưa phát hiện hình ảnh tổn thương tăng chuyển hóa FDG khư trú bất thường ở các vị trí khác.
Xét nghiệm máu:
Công thức máu: Các chỉ số trong giới hạn bình thường
Sinh hóa máu: GOT/GPT: 33/31; Ure/Creatinin: 5.1/63; Chỉ điểm u: CEA/CA 15-3: 2.14/24.8
- Đánh giá chức năng tim mạch:
Siêu âm tim: chức năng tâm thu thất trái nằm trong giới hạn bình thường
- ECG: không có kéo dài QTcF lớn hơn 480 msec
Chẩn đoán: Ung thư vú trái đã phẫu thuật, hóa xạ trị tiến triển di căn hạch thượng đòn trái. Mô bệnh học: Ung thư biểu mô tuyến ống di căn hạch, ER (3+), PR (-), Her-2 (-), Ki67 (15%).
Bệnh nhân được hội chẩn Hội đồng chuyên môn Ung thư Vú, quyết định điều trị toàn thân với liệu pháp nội tiết (thuốc đối kháng thụ thể estrogen) kết hợp với thuốc ức chế CDK 4/6.
- Fulvestrant (Faslodex) 50mg/mL 5mL: Khởi đầu 500mg/lần vào các ngày 1, 15 và 29 của tháng. Liều duy trì: 500mg/lần mỗi 28 ngày.
- Ribociclib (Kryxana 200mg): 600 mg/ngày đường uống trong 21 ngày liên tiếp, sau đó nghỉ 7 ngày điều trị, chu kỳ 28 ngày
Do điều kiện kinh tế một số đợt bệnh nhân không điều trị ribociclib nhưng vẫn duy trì điều trị thuốc nội tiết.
Theo dõi đáp ứng điều trị
Lâm sàng: Bệnh nhân không phát hiện khối bất thường tại thành ngực trái; không có bất thường hạch cổ hay hố nách hai bên được phát hiện thêm; xuất hiện phù cánh tay trái sau đó vật lý trị liệu đã đỡ.
Cận lâm sàng:
- Bệnh nhân không gặp các biến cố bất lợi phải dừng thuốc như hạ bạch cầu độ ≥ 3, thiếu máu, rối loạn tiêu hóa nặng hay kéo dài khoảng QTc.
Biến đổi chất chỉ điểm u:

Chất chỉ điểm u CA 15-3 là một trong yếu tố để theo dõi đáp ứng trong trường hợp này, khi mà bệnh nhân đã điều trị phẫu thuật cắt bỏ tuyến vú + nạo vét hạch. Đồ thị trên cho thấy nồng độ CA 15-3 bắt đầu giảm dần qua các đợt điều trị.
Theo dõi đáp ứng qua hình ảnh học:
Siêu âm tại các thời điểm 3 tháng sau điều trị, 6 tháng sau điều trị, 9 tháng sau điều trị, 12 tháng sau điều trị đều không phát hiện bất thường tại tuyến vú và hố nách hai bên, hạch vùng cổ không phát hiện hạch bệnh lý mới
CT ngực + bụng: ổ bụng không phát hiện tổn thương thứ phát. 11/2022 phát hiện khối hỗn hợp tỷ trọng phần mềm thành ngực trái, giữ nguyên kích thước so với phim chụp 14/06/2022. Kết hợp với siêu âm không nghĩ đến tổn thương tái phát.
| Phim chụp ngày 14/06/2022: Dày tổ chức kẽ kèm xẹp phổi. Nốt tỷ trọng hỗn hợp thành ngực 25x11mm, trong có vôi hóa, mỡ | Phim chụp ngày 23/11/2022: Nốt tỷ trọng hỗ hợp thành ngực không thay đổi kích thước và tính chất. | |
 |
 |
 |
Đánh giá sau điều trị, tình trạng bệnh đáp ứng đạt ổn định. Bệnh nhân tiếp tục được duy trì thuốc nội tiết nhóm ức chế thụ thể Estrogen (Fulvestrant), thuốc ức chế CDK 4/6 và theo dõi định kỳ.
Theo khuyến cáo của NCCN 2023 và Bộ Y Tế, đối với bệnh nhân ung thư vú tái phát, tiến triển hoặc ở giai đoạn muộn có di căn mà không có khủng hoảng tạng, điều trị kết hợp nội tiết và ức chế CDK4/6 (ribociclib, abemaciclib, palbociclib) là liệu pháp đầu tay. Về cơ chế tác động, nhóm thuốc này ức chế sự hoạt động của CDK 4/6 và qua đó ngăn chặn chu trình tế bào (Hình 1).

Hình 1. Ở các tế bào bình thường, phức hợp CDK4/6 được kích hoạt sẽ phosphoryl hóa protein ức chế khối u nguyên bào võng mạc (retinoblastoma, RB), cũng như các protein dạng túi liên quan p107 và p130. Quá trình phosphoryl hóa RB bởi CDK4/6 làm giảm một phần hoạt động của họ các yếu tố phiên mã E2F, do đó tạo điều kiện cho sự biểu hiện của các gen mục tiêu của E2F bao gồm cả các gen dành cho cyclin loại E (cyclin E1 và E2) [2] [3]. Sau đó, Cyclin E liên kết và kích hoạt CDK2, chất này tăng cường phosphoryl hóa RB, làm tăng hơn nữa sự biểu hiện của các gen mục tiêu của E2F giúp bắt đầu tổng hợp DNA và tế bào bước vào pha S [4].
Cả ba đều ức chế hoạt động enzyme của CDK4/6 ở cấp độ nano và có độ chọn lọc đối với CDK4 cao hơn CDK6 trong đó abemaciclib cũng có hoạt tính ức chế CDK rộng nhất, bao gồm hoạt tính ức chế bổ sung đối với các CDK khác nhưu CDK1, 2 và 9. Ở nồng độ cao hơn và điều trị kéo dài, abemaciclib đã được quan sát thấy có thể gây ra tự chết theo chương trình của tế bào so với tác dụng kìm tế bào của palbociclib và ribociclib. Tác dụng phụ hay gặp nhất bao gồm ức chế tủy xương và rối loạn tiêu hóa: Abemaciclib có ít tác dụng ức chế tủy xương nhất và được dùng liên tục, trong khi bệnh nhân được điều trị bằng palbociclib hoặc ribociclib cần nghỉ 7 ngày trong chu kỳ điều trị 28 ngày để tủy xương phục hồi [5]. Ngược lại, palbociclib và ribociclib có tần suất tác dụng phụ trên đường tiêu hóa cao hơn so với abemaciclib. Ngoài ra còn thấy sự kéo dài khoảng QTc với ribociclib và cần phải theo dõi QTc sau khi bắt đầu điều trị. [6].
Một phân tích cập nhật của nghiên cứu pha III MONALEESA-3, ribociclib cộng với fulvestrant đạt được thời gian sống sót tổng thể trung bình (mOS) là 67,6 tháng so với 51,8 tháng chỉ dùng fulvestrant, giúp giảm 33% tỷ lệ tử vong (HR = 0,673; 95% CI = 0,504–0,899). Với thời gian theo dõi kéo dài, tỷ lệ sống sót ước tính sau 5 năm là 56,5% so với 42,1%. Ngoài ra, 16,5% bệnh nhân dùng bộ đôi so với 8,6% bệnh nhân chỉ dùng fulvestrant vẫn đang được điều trị trong thời gian theo dõi dài hơn. Chúng tôi kỳ vọng bệnh nhân trong case lâm sàng này có thể đạt được hiệu quả điều trị lâm sàng không kém hơn kết quả trong nghiên cứu.
Tài liệu tham khảo
Howlader N., Altekruse S.F., Li C.I., et al. (2014). US Incidence of Breast Cancer Subtypes Defined by Joint Hormone Receptor and HER2 Status. JNCI: Journal of the National Cancer Institute, 106(5).
Talluri S., Isaac C.E., Ahmad M., et al. (2010). A G 1 Checkpoint Mediated by the Retinoblastoma Protein That Is Dispensable in Terminal Differentiation but Essential for Senescence. Molecular and Cellular Biology, 30(4), 948–960.
Narasimha A.M., Kaulich M., Shapiro G.S., et al. (2014). Cyclin D activates the Rb tumor suppressor by mono-phosphorylation. eLife, 3, e02872.
Weintraub S.J., Chow K.N.B., Luo R.X., et al. (1995). Mechanism of active transcriptional repression by the retinoblastoma protein. Nature, 375(6534), 812–816.
Klein M.E., Kovatcheva M., Davis L.E., et al. (2018). CDK4/6 Inhibitors: The Mechanism of Action May Not Be as Simple as Once Thought. Cancer Cell, 34(1), 9–20.
Braal C.L., Jongbloed E.M., Wilting S.M., et al. (2021). Inhibiting CDK4/6 in Breast Cancer with Palbociclib, Ribociclib, and Abemaciclib: Similarities and Differences. Drugs, 81(3), 317–331.