Xu hướng phát triển CAR trong trị liệu miễn dịch ung thư: từ CAR T, CAR NK đến CAR macrophage
TS. Hoàng Huyền Nga, GS.TS Mai Trọng Khoa, PGS.TS Phạm Cẩm Phương
Đơn vị Gen trị liệu, Trung tâm Y học hạt nhân và Ung bướu, Bệnh viện Bạch Mai
Khoa Kỹ thuật Y học, Trường Đại học Y Hà Nội
(Dịch và tóm tắt)
Điều trị miễn dịch ung thư (cancer immunotherapy) gần đây đã làm thay đổi việc điều trị ung thư và là lựa chọn thứ tư trong điều trị ung thư sau phẫu thuật, xạ trị và hóa trị. Hiện tại, nghiên cứu về liệu pháp miễn dịch triển vọng và thành công bao gồm thuốc ức chế điểm kiểm soát miễn dịch (immune checkpoint inhibitors – ICI) và liệu pháp tế bà (adoptive cell therapy – ACT) với chimeric antigen receptor (CAR) tế bào T (CAR-T). Đối với ICI, kháng thể kháng CTLA-4 (Cytotoxic T Lymphocyte-Associated Protein 4), PD1 (programmed cell death 1) và PD-L1 (programmed cell death 1 ligand 1) đã được FDA phê duyệt trong điều trị hơn 15 bệnh ác tính. Trong khi đó, chỉ có năm liệu pháp CAR T được phê duyệt cho điều trị các bệnh ung thư máu ác tính có nguồn gốc tế bào B, chưa có liệu pháp CAR nào được phê duyệt cho các khối u rắn. Một số trở ngại chính đối với liệu pháp miễn dịch CAR trong khối u rắn bao gồm sản xuất tế bào CAR T, thiếu kháng nguyên đặc hiệu cho khối u, lượng tế bào CAR T khu trú và xâm nhập vào khối ít, vi môi trường khối u (tumor microenviroment – TME) ức chế miễn dịch, độc tính liên quan đến trị liệu và mất kháng nguyên. Tế bào CAR NK (Natural Killer cell – tế bào diệt tự nhiên) có một số lợi thế so với tế bào CAR T vì tế bào NK có thể được sản xuất từ các dòng tế bào có sẵn hoặc tế bào NK ngoại sinh với sự không tương thích hệ kháng nguyên HLA hay MHC (major histocompatibility complex); có thể tiêu diệt tế bào ung thư đường phụ thuộc và không phụ thuộc CAR; ít độc tính hơn, đặc biệt là bão cytokine (Cytokine release syndrome) và nhiễm độc thần kinh. Ngoài tế bào T, NK, đại thực bào (Macrophages) có thể xâm nhập vào khối u một cách hiệu quả, là yếu tố điều hòa miễn dịch chính và hiện diện nhiều trong TME. Do đó, một hướng đi triển vọng là phát triển CAR Macrophages cho liệu pháp miễn dịch ung thư trong việc khắc phục nhược điểm của liệu pháp CAR T/NK, đặc biệt là trong các khối u rắn. Tuy nhiên, cả CAR NK và CAR macrophage đều có những hạn chế riêng. Bài viết này sẽ thảo luận về tình trạng hiện tại và những trở ngại chính liên quan đến liệu pháp CAR T và CAR NK, và nghiên cứu tiên tiến về phát triển CAR Macrophages như các tế bào thực bào đặc hiệu ung thư, trình diện kháng nguyên, chất kích thích miễn dịch và chất điều hòa môi trường vi mô khối u.
Cấu trúc CAR (chimeric antigen receptor)
CAR thường bao gồm 4 thành phần: vùng gắn kháng nguyên ngoại bào (extracellular antigen binding domain), vùng nối (spacer or hinge region), vùng xuyên màng (transmembrane domain)và vùng truyền tín hiệu nội bào (intracellular signaling domain). Vùng gắn kháng nguyên (antigen-binding domain) bao gồm các vùng biến đổi (variable regions – đặc hiệu với kháng nguyên) của chuỗi nặng (VH ) và nhẹ (VL) của kháng thể được nối với nhau bởi một cầu nối linh hoạt để tạo thành chuỗi đơn vùng biến đổi (singlechain fragment variable – scFv) và quyết định độ đặc hiệu trong liên kết với kháng nguyên. Không giống như TCR (T cell receptor – thụ thể nhận diện kháng nguyên trên tế bào T) nhận biết kháng nguyên được trình diện qua MHC, scFv nhận biết và liên kết với epitop bề mặt tế bào và xác định tính đặc hiệu của kháng nguyên.
Việc kích hoạt tế bào T chưa biệt hóa đòi hỏi ba tín hiệu, sự gắn kết của thụ thể tế bào T (TCR) với kháng nguyên được trình bày trên MHC, tín hiệu đồng kích thích (costimulators), cytokines. Sau khi TCR gắn kháng nguyên, thu hút và phosphoryl hóa adaptor protein CD3, tín hiệu từ TCR-CD3 cùng với sự gắn CD28-B7 hoạt hóa tế bào T. CAR là một thụ thể được thiết kế trên bề mặt tế bào liên kết với kháng nguyên bề mặt tế bào đích độc lập với MHC và kích hoạt các tế bào miễn dịch gây độc tế bào để tiêu diệt đặc hiệu tế bào đích biểu hiện kháng nguyên đó. Chức năng chính của nó là thay thế phức hợp TCR-CD3 và truyền tín hiệu chính để kích hoạt tế bào T như trong CAR thế hệ thứ nhất, hoặc cả tín hiệu chính từ phức hợp TCR-CD3 và tín hiệu đồng kích thích từ CD28 như đã thấy trong thế hệ thứ hai và thứ ba của CAR (Hình 1).\
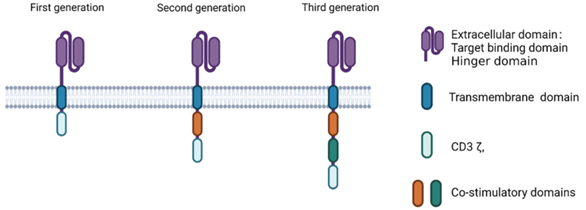
Hình 1. CAR trong CAR T, CAR NK và CAR macrophage có cấu trúc tương tự nhau
Hiện trạng liệu pháp tế bào CAR T
Cho đến nay, 5 liệu pháp CAR T đã được FDA chấp thuận đều nhắm vào mục tiêu là marker trên bề mặt tế bào lympho B bao gồm CD19 (CD19 – CAR T: 4 liệu pháp) và B cell maturation antigen – BCMA (BCMA – CAR T: 1 liệu pháp). Cả năm loại đều đã được phê duyệt để điều trị u lympho, bệnh bạch cầu có nguồn gốc tế bào B và đa u tủy (multiple myeloma). Ngoài ra, liệu pháp tế bào CAR T đang được phát triển để điều trị các bệnh khác như bệnh tự miễn và virus.
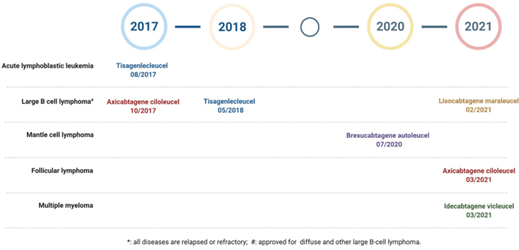
Hình 2. Liệu pháp CAR T được FDA phê duyệt
Hạn chế của tế bào CAR T trong liệu pháp miễn dịch ung thư
Lựa chọn kháng nguyên
Cho đến nay, tất cả các liệu pháp CAR được FDA phê chuẩn đều nhắm vào lympho B. Liệu pháp CAR T đối với các khối u rắn chưa được phát triển so với ung thư máu. Đối với khối u rắn, việc tìm ra kháng nguyên đặc hiệu là một trở ngại lớn. Các thử nghiệm lâm sàng với tế bào CAR T nhắm vào các kháng nguyên trong các khối u rắn như MART1 (kháng nguyên ung thư da nhận biết bởi tế bào T1) hoặc glycoprotein 100 (gp100) chỉ ra tác dụng phụ độc tính trên các tế bào bình thường mang kháng nguyên và có thể dẫn đến tử vong.
Kém hiệu quả trong lưu hành và xâm nhập tế bào CAR T vào khối u
Tại khối u, sự bất thường của thành mạch, các yếu tố ngoại bào dày đặc bao gồm cancer-associated fibroblast (CAFs) tạo ra một rào cản vật lý cho các tế bào CAR T xâm nhập vào vị trí khối u; sự biểu hiện không kiểm soát các cytokine thu hút các tế bào ức chế miễn dịch.
Môi trường vi mô khối u bất lợi
Khi vào TME, môi trường ức chế miễn dịch sẽ ức chế chức năng tế bào CAR T. Các thành phần tế bào như đại thực bào liên quan đến khối u (tumor-associated macrophages TAM), tế bào T điều hòa (Treg), tế bào ức chế dòng tủy (myeloid-derived suppressor cells MDSC). nguyên bào sợi khối u (TAF), các chất chuyển hóa tại khối u có thể ức chế trực tiếp chức năng CAR T, góp phần ức chế các cytokine. Yếu tố tăng trưởng nội mô mạch máu (VEGF) đóng một vai trò quan trọng trong quá trình tân mạch của khối u. Ngoài ra, TGF-β, IL-4, IL-10 và nhiều loại khác cũng góp phần gây rối loạn chức năng tế bào T và thúc đẩy sự xâm nhập của các tế bào ức chế miễn dịch. Nhiều phương pháp đã được sử dụng để tăng cường liệu pháp CAR T tại TME, chẳng hạn như kết hợp liệu pháp CAR T với ICI hoặc các liệu pháp kích thích miễn dịch khác, chế tạo tế bào CAR T kháng các cytokine ức chế miễn dịch.
Hiện tượng mất kháng nguyên
Một khi tế bào CAR T phát huy hoạt tính tiêu diệt tế bào ung thư, sự giảm biểu hiện và mất kháng nguyên dẫn đến thất bại điều trị. Mặc dù tỷ lệ đáp ứng ban đầu cao, 7–25% bệnh nhân được điều trị bằng liệu pháp CD19-CAR T tái phát với các khối u ác tính và giảm biểu hiện CD19. Việc thiết kế CAR T nhắm mục tiêu vào hai kháng nguyên khác nhau hoặc sử dụng liên tiếp nhiều liệu pháp CAR T đang được tích cực theo đuổi để giảm thiểu sự mất và giảm kháng nguyên.
Sự thiếu khả năng mở rộng và tồn tại của tế bào CAR T
Nuôi cấy ex vivo, kích hoạt và nhân rộng không chỉ tạo ra các tế bào T để tải nạp CAR gen, cung cấp đủ lượng tế bào CAR T cho ứng dụng lâm sàng mà còn rất quan trọng để duy trì chức năng và sự tồn tại của tế bào CAR T sau khi truyền vào cơ thể người bệnh. Nuôi cấy ex vivo dẫn đến sự biệt hóa sau cùng với xu hướng kích hoạt chết tế bào (activation-induced cell death AICD) và kiệt quệ có thể ảnh hưởng đến sự mở rộng và tồn tại của tế bào. Tối ưu hóa điều kiện nuôi cấy có thể cải thiện sự phát triển của tế bào CAR T nhớ (memory CAR T cells) cũng như khả năng nhân lên và tồn tại lâu dài trong cơ thể.
Gây độc toàn thân
Gây độc toàn thân của cytokine xảy ra trong giai đoạn cấp tính khi tế bào CAR T được kích hoạt và giải phóng cytokine như một phản ứng sinh lý đối với sự tham gia của CAR. Tác dụng nghiêm trọng và thậm chí gây tử vong được quan sát thấy với tất cả các liệu pháp CAR T đang hoạt động. Đối với hầu hết bệnh nhân, hội chứng bão cytokine (CRS) liên quan đến sốt, hạ huyết áp, thiếu oxy và suy đa cơ quan do nồng độ cytokine gây viêm cao. Một số bệnh nhân cũng có thể phát triển hội chứng nhiễm độc thần kinh liên quan đến tế bào tác động miễn dịch (immune effector cell-associated neurotoxicity syndrome).
Vấn đề trong thiết kế liệu pháp tế bào CAR T cho khối u rắn
Hiện tại, hơn 70% thử nghiệm lâm sàng tế bào CAR T tập trung vào ung thư máu và chưa đến 30% vào các khối u rắn. Một số vấn đề trong thiết kế liệu pháp CAR T trong các khối u rắn:
Lựa chọn kháng nguyên đích. Trong liệu pháp CAR T, kháng nguyên đích lý tưởng là những kháng nguyên đặc hiệu cho khối u chỉ biểu hiện trên tế bào ung thư. Trên thực tế, ngoại trừ kháng nguyên tân sinh ung thư và có thể cả biến thể thụ thể yếu tố tăng trưởng biểu bì III (EGFRvIII), hầu hết tất cả các kháng nguyên khác được sử dụng trong liệu pháp CAR T trong khối u rắn đều biểu hiện ở tế bào bình thường.
Ưu điểm chính của việc nhắm mục tiêu các kháng nguyên không đặc hiệu trong ung thư máu là: 1) có phương pháp điều trị hỗ trợ khi các tế bào bình thường bị phá hủy, như bổ sung immunoglobin trong điều trị bằng CD19 và BCMA – CAR T; và 2) tốc độ luân chuyển tế bào nhanh chóng bằng việc tạo ra các tế bào mới để bổ sung. Do đó, các tác dụng phụ trong ung thư máu thường có thể kiểm soát được.
Ngược lại, nhắm mục tiêu các kháng nguyên không đặc hiệu trong khối u rắn thường gây ra nhiều tác dụng phụ đáng kể hơn vì thường khó khắc phục tổn thương ngoài khối u ở các cơ quan.
Tính không đồng nhất của kháng nguyên cũng là một yếu tố quan trọng cần xem xét trong liệu pháp CAR T ở các khối u rắn. Đối với các marker không phải là yếu tố phát triển, biểu hiện không đồng nhất thường thấy ở các tế bào ung thư. Để khắc phục tính không đồng nhất của kháng nguyên đích, CAR hai hoặc đa đặc hiệu đã được đề xuất trong đó một CAR có thể nhận ra nhiều hơn một kháng nguyên đích. Một cách tiếp cận khác là đưa một số CAR, mỗi CAR nhắm vào một kháng nguyên khác nhau, vào cùng một tế bào T. Trong cả hai phương pháp, độc tính trên mục tiêu ở những tế bào ngoài khối u là mối quan tâm lớn vì tồn tại rất ít kháng nguyên đặc hiệu cho khối u.
Sự xâm nhập của tế bào CAR T vào khối u và duy trì độc tính tế bào là những trở ngại lớn trong khối u rắn. Một số phương pháp đang được khám phá để tăng cường hoạt động của tế bào CAR T trong khối u rắn. Một cách tiếp cận là tăng cường chức năng CAR T và trang bị cho các tế bào này các phân tử bổ sung để tăng cường hoạt động chống khối u. Ví dụ, việc gắn CAR T một thụ thể chemokine giúp tăng cường sự xâm nhập của tế bào T vào các khối u có tăng sản xuất chemokine.
Liệu pháp tế bào CAR NK để khắc phục nhược điểm của liệu pháp CAR T.
Tế bào NK (natural killer cells – tế bào diệt tự nhiên) là một nhóm tế bào lympho gây độc tế bào của hệ thống miễn dịch tự nhiên (innate immunity) có thể tạo ra phản ứng nhanh chóng với các tế bào lạ. Không giống như tế bào T nhận biết các kháng nguyên gắn trên MHC, tế bào NK có thể nhận biết trực tiếp tế bào đích khi không có MHC. Hơn nữa, kích hoạt tế bào CAR T có thể giải phóng cytokine gây viêm dẫn đến bão cytokine và nhiễm độc thần kinh, các tế bào NK có hệ cytokine khác. Do đó, tế bào NK hiện đang được tích cực nghiên cứu như một phương pháp thay thế cho liệu pháp tế bào.
Một ưu điểm chính của tế bào CAR NK so với tế bào CAR T là nguồn tế bào. Do khả năng dị ứng và mảnh ghép chống lại vật chủ (GVHD), liệu pháp CAR T yêu cầu sử dụng tế bào T tự thân. Vì những bệnh nhân này thường được điều trị lâu dài trước khi điều trị bằng CAR T nên nhiều người trong số họ có số lượng tế bào T thấp ở máu ngoại vi. Do đó, việc thu thập đủ tế bào T tự thân có thể làm trì hoãn đáng kể quá trình điều trị và đôi khi không thể thu thập đủ tế bào để sản xuất CAR T. Trong khi đó, tế bào NK không được kích hoạt thông qua con đường MHC và giảm nguy cơ phản ứng dị sinh nên không cần thiết phải sử dụng tế bào NK tự thân để sản xuất tế bào CAR NK. Có thể sử dụng dòng tế bào NK92, máu cuống rốn hiện có và tế bào gốc đa năng (iPSC). Trên thực tế, có 5 thử nghiệm lâm sàng sử dụng dòng tế bào NK-92 ở người. Trong một thử nghiệm sử dụng liệu pháp CAR NK không khớp HLA được phát triển từ máu cuống rốn, không ai trong số 11 bệnh nhân phát triển mảnh ghép chống lại vật chủ. Do đó, một ưu điểm chính của liệu pháp CAR NK là tế bào CAR NK sẵn có, sẵn sàng sử dụng, có thể được sản xuất hàng loạt và truyền cho bệnh nhân bất cứ lúc nào.
Ưu điểm lớn thứ hai của liệu pháp CAR NK so với liệu pháp CAR T là tác dụng phụ bão cytokine và nhiễm độc thần kinh. Trong số 11 bệnh nhân được điều trị bằng tế bào CD19 – CAR NK không khớp HLA có nguồn gốc từ máu dây rốn, không có bệnh nhân nào phát triển bão cytokine hoặc nhiễm độc thần kinh. Sự khác biệt của hai độc tính này giữa tế bào CAR T và NK có thể là thứ yếu do sự khác biệt về cytokine được giải phóng khi kích hoạt tế bào. Kích hoạt tế bào CAR T dẫn đến giải phóng các cytokine gây viêm, chẳng hạn như yếu tố hoại tử khối u TNF-α, IL-1β, IL-2 và IL-6, trong khi những bệnh nhân được điều trị bằng CAR NK không có sự gia tăng các cytokine gây viêm như vậy. Các tế bào CAR NK giải phóng hệ cytokine khác như yếu tố kích đại thực bào hạt (Granulocyte-macrophage colony-stimulating factor).
Thứ ba, tế bào NK có nhiều cơ chế để nhắm mục tiêu và loại bỏ tế bào ung thư ngoài con đường CAR . Tế bào NK là nhân tố chính gây độc tế bào qua trung gian kháng thể thông qua CD16 được biểu hiện trên tế bào NK. CD16 có thể nhận ra phần Fc của IgG liên kết trên tế bào khối u và tiêu diệt tế bào ung thư. Hơn nữa, tế bào NK có thể được kích hoạt để tiêu diệt tế bào ung thư thông qua sự gắn hoặc tách rời của thụ thể inhibitory killer Ig-like receptors (KIR) trên bề mặt tế bào. Các tế bào ung thư giảm sự biểu hiện MHC I và giải phóng sự ức chế KIR, hoặc tăng các phân tử gây ra căng thẳng như MICA/MICB (protein A/B liên quan đến chuỗi MHC lớp I) để tham gia kích hoạt các KIR định hướng quá trình kích hoạt của tế bào NK tiêu diệt tế bào đích.
Thứ tư, tế bào NK có đời sống ngắn . Tuổi thọ trung bình của tế bào NK là khoảng 2 tuần. Điều này có nghĩa là, trong trường hợp xảy ra độc tính ngoài khối u trên mục tiêu, nó có thể tự giới hạn bằng sự biến mất của tế bào CAR NK. Tuy nhiên, điều này cũng đồng nghĩa với việc có thể cần phải truyền nhiều lần tế bào CAR NK trong điều trị.
So sánh các cấu trúc CAR
Cho đến nay, hầu hết các CAR được sử dụng cho các nghiên cứu tế bào CAR NK đều sử dụng cùng cấu trúc CAR như được sử dụng trong các tế bào CAR T có cùng các miền nội bào của CD3ζ như trong các tế bào CAR T thế hệ đầu tiên hoặc CD3ζ kết hợp với miền đồng kích thích 4-1BB như được sử dụng trong tế bào CAR T thế hệ thứ hai. Việc bổ sung miền đồng kích thích 4-1BB cải thiện đáng kể sự kích hoạt tế bào NK, độc tính tế bào và sản xuất các cytokine, chẳng hạn như interferon-γ và yếu tố kích thích tạo đại thực bào -bạch cầu hạt.
Để tối ưu hóa hơn nữa cấu trúc CAR cho tế bào NK, tế bào CAR NK chứa miền xuyên màng NKG2D, miền đồng kích thích 2B4 và miền tín hiệu CD3ζ thể hiện độc tính tế bào đặc hiệu với kháng nguyên. Các tế bào CAR NK được phát triển từ Tế bào gốc đa năng cảm ứng (iPSC) có kiểu hình tế bào NK điển hình và có hoạt tính chống khối u đáng kể và có khả năng tồn tại kéo dài trong cơ thể.
Thực trạng liệu pháp tế bào CAR NK
Cho đến nay, ít nhất 24 thử nghiệm lâm sàng với tế bào CAR NK đã được lên kế hoạch hoặc đang diễn ra. Sử dụng các từ khóa “chimeric” và “NK”, chỉ có một thử nghiệm lâm sàng được xác định tại PubMed.
Trong thử nghiệm này, cấu trúc CAR tương tự như tế bào CAR T đã được sử dụng với scFv kháng CD19 ngoại bào và CD3ζ làm miền tín hiệu nội bào. Ngoài ra, các tế bào CAR NK biểu hiện interleukin-15 để tăng cường sự nhân lên của các tế bào CAR NK, và rimiducid-inducible caspase-9 (caspase-9 được điều chỉnh bằng rimiducid) như một biện pháp an toàn để kích hoạt quá trình tự hủy của tế bào CAR NK trong trường hợp xảy ra các tác dụng phụ nghiêm trọng.
Nhược điểm của liệu pháp tế bào CAR NK
Mặc dù những ưu điểm của liệu pháp tế bào CAR NK so với liệu pháp tế bào CAR T là rõ ràng như đã thảo luận ở trên, nhưng cũng tồn tại những hạn chế đáng kể. Hầu như tất cả các hạn chế liên quan đến liệu pháp CAR T cũng tồn tại với tế bào CAR NK, từ lựa chọn kháng nguyên đích, tính không đồng nhất của kháng nguyên, thiết kế CAR, sản xuất cho đến những thách thức sau tiêm truyền, chẳng hạn như sự di chuyển của tế bào NK vào vị trí khối u, môi trường vi mô khối u.
Trên thực tế, MHC gắn vào các thụ thể tiêu diệt giống globulin miễn dịch của tế bào (KIR) trên tế bào NK và ức chế chức năng tế bào NK. Các phân tử MHC được biểu hiện phổ biến trên các tế bào có nhân có thể ức chế chức năng tế bào NK.
Liệu pháp CAR macrophages để khắc phục nhược điểm của liệu pháp CAR T và CAR NK
Do những trở ngại liên quan đến liệu pháp tế bào CAR T và CAR NK, gần đây CAR macrophages được nghiên cứu như một liệu pháp thay thế. CAR macrophages có nhiều đặc điểm và trở ngại như tế bào CAR T, chẳng hạn như yêu cầu về kháng nguyên cụ thể, thoát và điều hòa kháng nguyên cũng như độc tính của cytokine toàn thân. Tuy nhiên, CAR macrophages có những ưu điểm vượt trội so với tế bào CAR T ở hai rào cản lớn khác trong khối u rắn: lưu hành tế bào miễn dịch và xâm nhập vào vi môi trường khối u và ức chế miễn dịch của khối u.
Trái ngược với sự xâm nhập kém của tế bào T, đại thực bào (macrophages) tồn tại rất nhiều trong nhiều khối u. Đại thực bào chiếm phần lớn các tế bào xâm nhập khối u trong nhiều loại ung thư, lên tới 50% trong khối u ác tính, ung thư thận và ung thư đại trực tràng. Hơn nữa, đại thực bào có thể cảm nhận trực tiếp tình trạng thiếu oxy, các chất chuyển hóa yếm khí như độ pH thấp và di chuyển vào khối u.
Một tính năng khác tại vi môi trường khối u gây trở ngại lớn cho tế bào T nhưng ít cản trở hơn đối với đại thực bào là môi trường vi mô ức chế miễn dịch. Các tế bào T xâm nhập vào vị trí khối u thường tiến triển kiểu hình kiệt sức và đôi khi không thể đảo ngược bằng thuốc ức chế điểm kiểm soát miễn dịch. Các đại thực bào được gồm hai nhóm chính, các đại thực bào M1 (gây viêm) được kích hoạt thường quy và các đại thực bào M2 chống viêm được kích hoạt xen kẽ. M2 là một trong những quần thể tế bào ức chế miễn dịch trung tâm tại khối u. Trên thực tế, đại thực bào M2 có khả năng thực bào cao hơn đại thực bào M1. Hơn nữa, các đại thực bào có thể biến đổi kiểu hình M1 ↔ M2 theo kích thích môi trường.
Cấu trúc CAR trong CAR macrophages
CAR trong CAR macrophages có cấu trúc tương tự như trong tế bào CAR T với miền liên kết kháng nguyên ngoại bào, vùng bản lề, miền xuyên màng và miền nội bào. Chúng khác nhau ở miền tín hiệu nội bào, CAR T được thiết kế với CD3ζ – costimulator (CD28 hoặc 4-1BB) trong khi Các CAR macrophages với bất kỳ miền nội bào chứa thụ thể miễn dịch kích hoạt bởi tyrosine ITAM (immunoreceptor tyrosine-based activation motifs): CD3ζ, FcRγ hoặc Megf10, đều có hiệu quả thực bào tương đương.
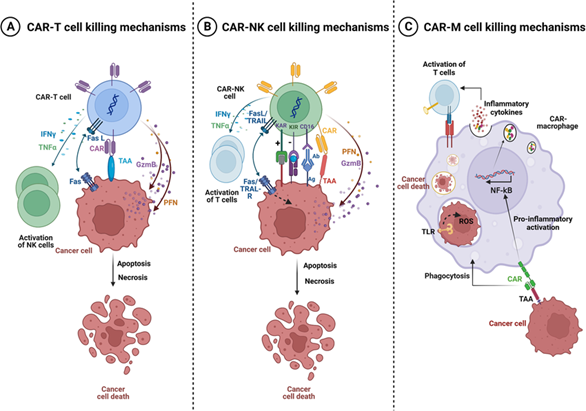
Hình 3. Cơ chế tiêu diệt tế bào đích của CAR T, CAR NK và CAR Macrophage.
Hiện trạng trong nghiên cứu CAR macrophages
Cho đến nay, CAR macrophages chủ yếu ở giai đoạn tiền lâm sàng với một thử nghiệm giai đoạn I đang diễn ra sử dụng CAR macrophages tự thân nhắm vào khối u rắn có tăng biểu hiện HER2. CAR macrophages được thiết kế bằng vec tơ adenovirus Ad5f35 mang scFv nhắm mục tiêu gắn HER2. Nhiễm adenovirus gây ra sự biệt hóa của đại thực bào thành kiểu hình giống M1 gây viêm.
CAR macrophages vẫn đang ở giai đoạn sơ khai với chỉ một thử nghiệm lâm sàng được bắt đầu và chưa có kết quả nào được báo cáo. Vì vậy, nhiều hạn chế vẫn chưa được bộc lộ.
Một ưu điểm chính của việc sử dụng đại thực bào là xu hướng di chuyển và xâm nhập vào khối u. Với tính linh hoạt của sự khác biệt giữa kiểu hình M1 gây viêm và kiểu hình M2 chống miễn dịch, sự xâm nhập cao của đại thực bào vào khối u và biệt hóa thành kiểu hình M2 có thể thúc đẩy sự phát triển và di căn của ung thư. Vì vậy, sự phát triển và duy trì kiểu hình M1 đang được tập trung nghiên cứu.
Kết luận
Tóm lại, cho đến nay, liệu pháp tế bào với CAR T đã đạt được tiến bộ vượt bậc trong điều trị ung thư máu năm liệu pháp CAR T đã được FDA phê duyệt. Liệu pháp CAR T ở các khối u rắn chưa được phát triển do thiếu kháng nguyên đặc hiệu, hiệu quả của lưu hành và di chuyển tế bào CAR T vào vị trí khối u, môi trường khối u ức chế miễn dịch. Tế bào CAR NK cũng đã được nghiên cứu và đưa vào thử nghiệm lâm sàng. Có một số ưu điểm của tế bào CAR NK. Tuổi thọ hạn chế của tế bào NK có nghĩa là nguy cơ nhiễm độc ở tế bào bình thường ngoài khối u thấp hơn; hệ cytokine do tế bào NK giải phóng làm giảm nguy cơ bão cytokine và nhiễm độc thần kinh; và giảm nguy cơ thải ghép dẫn tới bất hoạt CAR NK bằng cách sử dụng các dòng tế bào NK sẵn có. Đại thực bào là một trong những tế bào miễn dịch chính có thể xâm nhập vào vi môi trường khối u. Ngay cả các đại thực bào M2 ức chế miễn dịch cũng có hoạt tính thực bào mạnh mẽ. Gần đây, CAR macrophage đang được nghiên cứu như một phương pháp thay thế. Các nghiên cứu tiền lâm sàng đã cho thấy hoạt động chống khối u đầy hứa hẹn với một thử nghiệm lâm sàng với CAR macrophage nhắm vào các khối u rắn biểu hiện HER2 đang diễn ra. Liệu pháp CAR macrophage trong tương lai vẫn cần phải vượt qua một số trở ngại khác gặp phải với liệu pháp CAR T. Do các đại thực bào liên quan đến khối u là loại tế bào chính và chất điều hòa miễn dịch chính tại vi môi trường khối u, nên một hướng nghiên cứu chính là phát triển CAR macrophage không chỉ như một bộ máy thực bào mà quan trọng hơn là một chất trình diện kháng nguyên, chất điều chỉnh vi môi trường khối u và chất kích thích miễn dịch để thúc đẩy khả năng chống ung thư.
Tài liệu tham khảo:
1. Pan K, Farrukh H, Chittepu VCSR, Xu H, Pan CX, Zhu Z. CAR race to cancer immunotherapy: from CAR T, CAR NK to CAR macrophage therapy. J Exp Clin Cancer Res. 2022 Mar 31;41(1):119. doi: 10.1186/s13046-022-02327-z.
Link: https://jeccr.biomedcentral.com/articles/10.1186/s13046-022-02327-z
2. Maalej KM, Merhi M, Inchakalody VP, Mestiri S, Alam M, Maccalli C, Cherif H, Uddin S, Steinhoff M, Marincola FM, Dermime S. CAR-cell therapy in the era of solid tumor treatment: current challenges and emerging therapeutic advances. Mol Cancer. 2023 Jan 30;22(1):20. doi: 10.1186/s12943-023-01723-z.
Link: https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-023-01723-z