Case lâm sàng: Điều trị bổ trợ bệnh nhân ung thư mô đệm đường tiêu hoá có đột biến gen KIT tại Trung tâm Y học hạt nhân và Ung bướu – Bệnh viện Bạch Mai
GS.TS. Mai Trọng Khoa, PGS.TS. Phạm Cẩm Phương, TS. Phạm Văn Thái,
Ths.BS. Lê Văn Long, BSNT. Đỗ Đăng Thọ.
Trung tâm Y học hạt nhân và Ung bướu- Bệnh viện Bạch Mai
U mô đệm đường tiêu hóa (Gastrointestinal Stromal Tumors – GISTs) là một nhóm u trung mô đặc biệt của đường tiêu hóa, bắt nguồn chủ yếu từ các tế bào kẽ của Cajal – loại tế bào đóng vai trò như “máy tạo nhịp” cho nhu động ruột, hoặc từ những tế bào có nguồn gốc tương tự trong thành ống tiêu hóa.[1] Đây là một bệnh lý hiếm gặp, tỷ lệ mắc chỉ chiếm khoảng 0,2% trong số tất cả các bệnh lý của đường tiêu hóa và khoảng 1–2% trong nhóm các khối u ác tính đường tiêu hóa.[1,2].
Về dịch tễ học, GISTs có thể được phát hiện ở nhiều độ tuổi khác nhau, tuy nhiên phần lớn các trường hợp xuất hiện ở lứa tuổi trung niên và cao tuổi. Độ tuổi trung bình khi được chẩn đoán thường nằm trong khoảng 65–69 tuổi, trong khi đó các trường hợp phát hiện ở người trẻ dưới 40 tuổi rất hiếm gặp.[2]
Khối u có thể khởi phát từ bất kỳ vị trí nào trên ống tiêu hóa. Trong đó, dạ dày là vị trí nguyên phát phổ biến nhất, chiếm khoảng 60% các trường hợp, tiếp đến là ruột non. Các vị trí ít gặp hơn gồm: tá tràng (4–5%), trực tràng, trong khi rất hiếm khi ghi nhận GISTs phát sinh từ thực quản (<1%) hoặc đại tràng (1–2%). Khi bệnh tiến triển xa, các cơ quan bị di căn thường gặp nhất là gan và/hoặc phúc mạc; ít gặp hơn là phổi hoặc các cơ quan khác.[3]
Về cơ chế bệnh sinh, đa số các GISTs có biểu hiện dương tính với KIT (CD117). Khoảng 80% trường hợp mang đột biến gen KIT – gen mã hóa cho thụ thể tyrosine kinase KIT. Ngoài ra, khoảng 5–10% trường hợp mang đột biến gen PDGFRA (platelet-derived growth factor receptor alpha). Đáng chú ý, khoảng 10–15% GISTs không phát hiện đột biến ở cả hai gen KIT và PDGFRA, được xếp vào nhóm wild-type GISTs, vốn có đặc điểm sinh học và tiên lượng khác biệt so với nhóm còn lại.[4,5]
Trong nhiều thập kỷ trước năm 2001, các phương pháp điều trị toàn thân đối với GISTs hầu như không đem lại hiệu quả rõ rệt, bệnh nhân ở giai đoạn tiến triển hoặc di căn có tiên lượng rất xấu. Bước ngoặt quan trọng chỉ xuất hiện khi các nghiên cứu làm sáng tỏ vai trò trung tâm của tín hiệu KIT/PDGFRA trong cơ chế sinh u. Phát hiện này mở ra một kỷ nguyên mới trong điều trị nhắm trúng đích, tiêu biểu là sự ra đời của Imatinib – một thuốc ức chế tyrosine kinase đường uống, có khả năng ức chế chọn lọc BCR-ABL, KIT và PDGFRA. Nhiều thử nghiệm lâm sàng quy mô lớn đã chứng minh hiệu quả vượt trội của Imatinib, giúp cải thiện tỷ lệ đáp ứng, kéo dài thời gian sống thêm và nâng cao chất lượng cuộc sống của bệnh nhân GISTs giai đoạn tiến triển hoặc di căn.[6] Nhờ đó, Imatinib nhanh chóng được công nhận là liệu pháp chuẩn trong điều trị GISTs giai đoạn tiến triển/di căn.
Không chỉ dừng lại ở vai trò điều trị bệnh tiến triển, ngày càng nhiều bằng chứng khoa học cho thấy Imatinib còn mang lại lợi ích rõ rệt trong điều trị bổ trợ sau phẫu thuật triệt căn, đặc biệt ở nhóm bệnh nhân có nguy cơ tái phát cao (ví dụ: u kích thước lớn, chỉ số phân bào cao, vị trí ngoài dạ dày…). Các nghiên cứu đã khẳng định điều trị bổ trợ bằng Imatinib giúp kéo dài thời gian sống thêm không bệnh (DFS) đồng thời cải thiện sống còn toàn bộ (OS). Chính vì vậy, các hướng dẫn quốc tế như NCCN, ESMO hiện đều khuyến cáo sử dụng Imatinib bổ trợ thường quy trong các trường hợp GISTs nguy cơ cao sau phẫu thuật triệt căn.[7–9]
Sau đây là ca lâm sàng bệnh nhân GIST có đột biến KIT được chẩn đoán và điều trị bổ trợ bằng Imatinib tại Trung tâm Y học hạt nhân và Ung bướu – Bệnh viện Bạch Mai.
Họ và tên: L.V. T Giới: Nam Tuổi: 57 tuổi
Thời gian vào viện: Tháng 7 năm 2025
Lý do vào viện: Đau bụng từng cơn vùng quanh rốn
Tiền sử:
– Bản thân: chưa phát hiện bệnh lí mạn tính, bệnh lí liên quan.
– Gia đình: không ai mắc bệnh ác tính.
Bệnh sử:
Bệnh nhân vào viện vì đau bụng từng cơn tăng dần vùng quanh rốn, không buồn nôn, không nôn, vào viện được chẩn đoán Tắc ruột do GIST ruột non. Bệnh nhân được chỉ định phẫu thuật nội soi cắt đoạn ruột non, chẩn đoán trong mổ: GIST ruột non chảy máu. Bệnh nhân được tiến hành cắt mạc treo ruột non, cắt đoạn ruột non có u nối tận tận. Hiện tại, sau mổ 7 ngày, bệnh nhân ổn định → Vào Trung tâm Y học hạt nhân và ung bướu – Bệnh viện Bạch Mai điều trị tiếp.
Khám vào viện:
Bệnh nhân tỉnh, tiếp xúc được.
Thể trạng trung bình (chiều cao: 165 cm, cân nặng: 60 kg), chỉ số toàn trạng PS: 0
Da, niêm mạc hồng, không phù, không xuất huyết dưới da
Hạch ngoại biên: không sờ thấy
Tim mạch: nhịp đều, rõ, tần số 80 chu kỳ/phút, huyết áp 120/80 mmHg.
Hô hấp: rì rào phế nang rõ, không có tiếng ran bệnh lí
Tiêu hóa: bụng mềm, không chướng, gan lách không sờ thấy, vết mổ liền tốt
Các cơ quan bộ phận khám chưa phát hiện bất thường
Cận lâm sàng:
– Công thức máu, sinh hóa máu, đông máu cơ bản trong giới hạn bình thường.
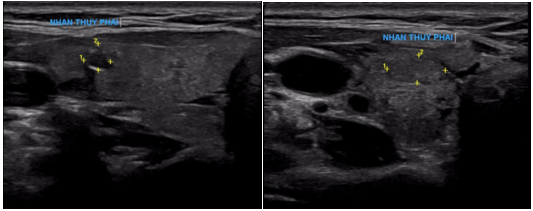
– Siêu âm ổ bụng (11/07/2025): Vùng hạ vị có khối giảm âm, kích thước 45x44mm, tăng sinh mạch, ranh giới không rõ với quai ruột non chưa loại trừ GIST.
– Chụp cắt lớp vi tính ổ bụng (11/07/2025) – trước phẫu thuật:
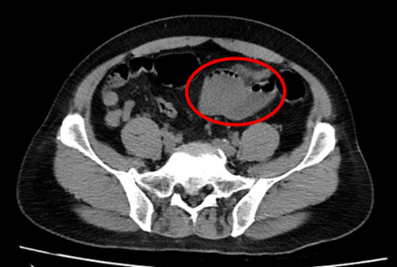
Hình 1: Hình ảnh chụp cắt lớp vi tính ổ bụng: Quai hồi tràng vùng hạ vị dày thành không đều, tạo khối kích thước 49x47mm (vòng tròn đỏ), thâm nhiễm mỡ xung quanh, ngấm thuốc mạnh đồng nhất sau tiêm.
– Chụp cắt lớp vi tính ổ bụng (06/08/2025) – sau phẫu thuật:
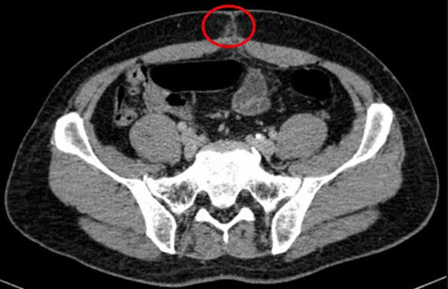
Hình 2: Hình ảnh chụp cắt lớp vi tính ổ bụng: Hình ảnh thâm nhiễm mỡ vùng hạ vị quanh vị trí vết mổ (vòng tròn đỏ).
– Chụp cắt lớp vi tính ngực (11/07/2025) – trước phẫu thuật:
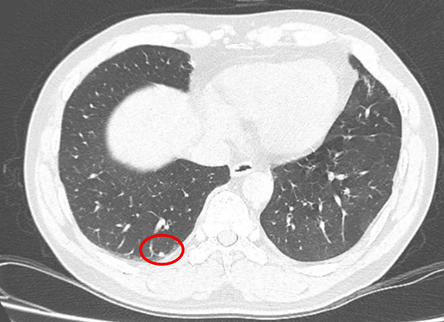
Hình 3: Hình ảnh chụp cắt lớp vi tính lồng ngực: Hình ảnh các nốt đặc rải rác 2 bên phổi, nốt lớn nhất kích thước 4mm (vòng tròn đỏ).
– Chụp cắt lớp vi tính ngực (06/08/2025) – sau phẫu thuật:
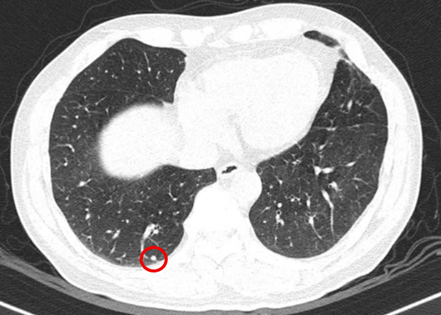
Hình 4: Hình ảnh chụp cắt lớp vi tính lồng ngực: Hình ảnh các nốt đặc rải rác 2 bên phổi, nốt lớn nhất kích thước 4mm (vòng tròn đỏ).
– Giải phẫu bệnh sau mổ: U tế bào hình thoi hướng đến GIST.
– Hóa mô miễn dịch: Hình ảnh mô bệnh học và hóa mô miễn dịch phù hợp với GIST, nguy cơ thấp.
– Xét nghiệm gen: Phát hiện đột biến trên Exon 11 gen KIT; không phát hiện đột biến p.D842V trên exon 18 gen PDGFRA.
Chẩn đoán xác định:
GIST ruột non có biến chứng chảy máu, đã phẫu thuật pT2N0M0, có đột biến gen KIT, nguy cơ cao
Hướng điều trị tiếp theo: Imatinib 400mg/ ngày trong 3 năm.
Bàn luận: U mô đệm đường tiêu hóa (GIST) là một bệnh lý hiếm gặp nhưng có ý nghĩa lâm sàng quan trọng nhờ tiến bộ trong chẩn đoán và điều trị nhắm trúng đích. Trường hợp bệnh nhân của chúng tôi được chẩn đoán GIST ruột non có đột biến gen KIT, sau phẫu thuật triệt căn đã được chỉ định điều trị bổ trợ bằng Imatinib. Qua ca bệnh này, có thể khẳng định tầm quan trọng của xét nghiệm mô bệnh học, hóa mô miễn dịch và xét nghiệm gen trong chẩn đoán xác định GIST. Điều trị tiêu chuẩn cho GIST có đột biến gen KIT ở nhóm nguy cơ cao là phẫu thuật triệt căn và Imatinib bổ trợ theo khuyến cáo quốc tế. Trường hợp lâm sàng góp phần minh chứng hiệu quả và vai trò then chốt của điều trị nhắm trúng đích trong quản lý bệnh nhân GIST tại Việt Nam, đồng thời nhấn mạnh sự cần thiết của việc chẩn đoán sớm và cá thể hóa điều trị.
Tài liệu tham khảo
- Miettinen M, Lasota J. Gastrointestinal stromal tumors: Pathology and prognosis at different sites. Semin Diagn Pathol. 2006;23(2):70–83.
- Søreide K, Sandvik OM, Søreide JA, Giljaca V, Jureckova A, Bulusu VR. Global epidemiology of gastrointestinal stromal tumours (GIST): A systematic review of population-based cohort studies. Cancer Epidemiol. 2016;40:39–46.
- Joensuu H, Hohenberger P, Corless CL. Gastrointestinal stromal tumour. Lancet. 2013;382(9896):973–983.
- Hirota S, Isozaki K, Moriyama Y, et al. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science. 1998;279(5350):577–580.
- Corless CL, Fletcher JA, Heinrich MC. Biology of gastrointestinal stromal tumors. J Clin Oncol. 2004;22(18):3813–3825.
- Demetri GD, von Mehren M, Blanke CD, et al. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med. 2002;347(7):472–480.
- Dematteo RP, Ballman KV, Antonescu CR, et al. Adjuvant imatinib mesylate after resection of localised, primary gastrointestinal stromal tumour: A randomised, double-blind, placebo-controlled trial. Lancet. 2009;373(9669):1097–1104.
- Joensuu H, Eriksson M, Sundby Hall K, et al. Adjuvant imatinib for high-risk GI stromal tumor: Analysis of a randomized trial. J Clin Oncol. 2016;34(3):244–250.
- NCCN Clinical Practice Guidelines in Oncology. Soft Tissue Sarcoma. Version 1.2024.